„Reduce, reuse, recycle“
Der fundamentale biologische Prozess der „Müllentsorgung“ in Zellen steht im Mittelpunkt des Forschungsinteresses des Teams um Assoz. Prof. Priv.-Doz. Dr. David Teis von der Sektion für Zellbiologie am Biozentrum. In einer neuen Forschungsarbeit, die im renommierten Open Access Magazin eLife erschienen ist, berichten die Forscher über zwei unterschiedliche zelluläre Abfallsysteme, deren Zusammenarbeit das Überleben der Zelle unter Hungerbedingungen ermöglicht.
Wenn Zellen aufgrund von ungenügender Versorgung hungrig sind – etwa im Rahmen der Entwicklung solider Tumoren oder auch in Entwicklungsphasen wie beim Neugeborenen –, sind sie auf Recyclingprozesse angewiesen, um die zelluläre Homöostase aufrecht zu erhalten, also um wachsen und überleben zu können.
Diese Mechanismen, die komplexe Organismen wie auch den Modellorganismus Hefe vor Hunger schützen, verlaufen entlang genau programmierter Abläufe, sodass Proteine und andere Zellbestandteile, die ihre Funktion erfüllt haben, altern oder defekt sind, abgebaut und ihre Bestandteile „recycled“ und wieder aufgebaut werden. „Wir wissen aus vorangegangenen Forschungen, dass der Prozess der Autophagie besonders wichtig ist und in Hungerphasen stark aktiviert wird“, so David Teis, der an der Sektion für Zellbiologie (Direktor: Univ.-Prof. Dr. Lukas A. Huber) am Innsbrucker Biozentrum das Membrane Traffic and Signaling Forschungslabor leitet.
Kooperative Überlebensstrategie
Die Autophagie ist ein streng regulierter Selbstverdauungsprozess. Unter Stress-Bedingungen wie Hunger, wird Autophagie stark induziert und beginnt, nicht-selektiv eigene zelluläre Bestandteile quasi aufzufressen, um so den Nahrungsmangel auszugleichen. Um ihre essentiellen Lebensfunktionen aufrecht zu erhalten, wechselt die Zelle also von einer Wachstums- in eine Ruhephase. Fehler in diesem Prozess können zu Krankheiten wie Krebs, Neuro-Degeneration oder erhöhter Infektionsanfälligkeit führen.
Doch nicht nur Autophagie allein ist für diese Überlebensstrategie verantwortlich. „In unseren Untersuchungen konnten wir zeigen, dass über den MVB*) Transportweg ganz am Anfang der Hungerphase sehr selektiv Membranproteine abgebaut werden“, erzählen die beiden Erstautoren Dr. Oliver Schmidt – übrigens neben Mag.Dr. Luca Fava aus dem Team um Prof. Andreas Villunger (Sektion für Entwicklungsimmunologie) einer von zwei EMBO-Stipendiaten an der Medizinischen Universität Innsbruck – und Dr. Martin Müller. „Über diesen Protein-Abbauweg hat die Zelle die Chance, vor Autophagie jene Proteine auszuwählen, die nicht abgebaut und somit auch nicht wieder aufgebaut werden müssen – der `Netto-Gewinn´ über den MVB-Signalweg ist zu Beginn also höher als bei der Autophagie“, kommentiert der Zellbiologe Teis. Erst die Kooperation dieser beiden Recycling-Systeme ermöglicht es der Zelle also, ihre Funktionen unter Nahrungsknappheit am Laufen zu halten.
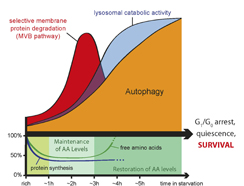
Bild: Die katabolische Kaskade unter Hungerbedingungen. Zuerst trägt der selektive Abbau von Membrane-Proteine über den MVB pathway entscheidend zum Recycling von Aminosäuren bei und später übernimmt Autophagie diese Aufgabe.
Auf Grundlage dieser Ergebnisse wollen die Forscher um David Teis nun jene molekularen Mechanismen unter die Lupe nehmen, die entscheiden, welche Plasma-Membran Proteine abgebaut werden und damit für das Überleben der Zelle besondere Relevanz besitzen.
Open Access Publikation
Die in Zusammenarbeit mit Teams vom Biozentrum um ao.Univ.-Prof. Dr. Herbert Lindner von der Sektion für Klinische Biochemie und Univ.-Prof. DI Dr. Zlatko Trajanoski, Leiter der Sektion für Bioinformatik sowie der Gruppe von Assoz. Prof. Dr. Claudine Kraft (MFPL, Wien), entstandene Arbeit wurde kürzlich im Open Access Magazin eLife publiziert. Das 2012 von Medizin-Nobelpreisträger Randy Schekman als Open Access Konkurrenz zu Cell, Science und Nature gegründete Journal wird vom Howard Hughes Medical Institute, der Max Planck Gesellschaft und dem Wellcome Trust gesponsert. Univ.-Prof.in Dr.in Christine Bandtlow, Vizerektorin für Forschung und Internationales, begrüßt die Open Access Publikation: „Das schon aufgrund seiner Repräsentanten renommierte Journal eLife punktet nicht nur mit Qualität, sondern in Sachen Begutachtung vor allem mit Transparenz. Es ist zudem ein zentraler Anspruch der Medizinischen Universität Innsbruck, die Forschungsergebnisse unserer WissenschafterInnen zum Nutzen aller möglichst rasch, umfassend und kostenfrei verfügbar zu machen. Darüber hinaus ist Open Access ein Grundprinzip für alle wissenschaftlichen Publikationen, die im Rahmen eines unter Horizon 2020 gesponserten Projektes entstanden sind.“
Die Forschungsleistungen der Arbeitsgruppe Teis werden durch den FWF (START, SFB021, MCBO) und das Human Frontier Science Program (HFSP) an Dr. David Teis sowie durch ein EMBO long term fellowship und eine MUI START Förderung an seinen Mitarbeiter Dr. Oliver Schmidt unterstützt.
*) MVBs (multivesicular bodies), sogenannte Transportcontainer, transportieren Zellbestandteile ins Lysosom, den Ort Ihres Abbaus in der Zelle.
(D. Heidegger)
Links:
The coordinated action of the MVB pathway and autophagy ensures cell survival during starvation. Müller M, Schmidt O, Angelova M, Faserl K, Weys S, Kremser L, Pfaffenwimmer T, Dalik T, Kraft C, Trajanoski Z, Lindner H, Teis D. Elife. 2015 Apr 22;4.
http://dx.doi.org/10.7554/eLife.07736
Arbeitsgruppe Teis
https://www.i-med.ac.at/cellbio/labore/Membrane_Traffic_and_Signaling/index.html
Sektion für Zellbiologie
http://biocenter.i-med.ac.at/cell-biology
Biozentrum Innsbruck
http://biocenter.i-med.ac.at/
Archiv:
Wie Zellen ihren Sondermüll entsorgen
https://www.i-med.ac.at/mypoint/news/682025.html
ESCRTs: Molekularer Verpackungsautomat für Rezeptoren
https://www.i-med.ac.at/mypoint/archiv/2010021401.xml





